试验方法丨一文了解遗传毒性试验——小鼠淋巴瘤细胞TK突变试验
遗传毒性试验是指采用哺乳动物或非哺乳动物细胞、细菌、酵母菌、真菌或整体动物测定试验样品是否会引起基因突变、染色体结构畸变以及其他 DNA 或基因变化的试验。
欢迎各位关注威科检测集团,交流行业话题,推送行业时事,助你医械事业快速成长!

遗传毒性试验的意义
随着公众对医疗器械遗传效应和致癌性的担忧不断增加,遗传毒性试验已成为监管机构对高风险医疗器械的必备要求。它是对医疗器械安全性的重要评估手段,能够帮助保障公众的健康与安全。


宜考虑遗传毒性试验的产品
根据GB/T 16886.1-2022 (ISO 10993-1:2018),以下几类接触风险的产品需要考虑进行遗传毒性检测:
与黏膜接触的长期接触的表面医疗器械,如:带针可吸收缝合线
与组织/骨/牙本质长期或持久接触的外部接入医疗器械,如:铜镍钛正畸丝;定制式矫治器
与血液循环接触的植入医疗器械,如:人工血管、封堵止血植入体
血液循环短期接触的外部接入医疗器械,如:一次性使用引流导管及附件;血管鞘组;神经血管导丝、透析液过滤器
遗传毒性试验主要用于检测两类遗传损伤:基因突变(点突变)和染色体损伤[结构畸变如易位、小或大缺失和插入、染色体数目畸变(非整倍体)]。单一试验无法检测出所有相关遗传毒性物质。如在细菌系统中产生潜在 DNA损伤的试验材料与它们在真核细胞中的作用可能不具有相关性,因此,除非进行论证,否则应在哺乳动物细胞试验系统中进行试验。按照OECD导则通常进行组合体外试验,组合包括:细菌回复突变+体外哺乳动物细胞染色体畸变试验;细菌回复突变+体外小鼠淋巴瘤TK试验;细菌回复突变+体外哺乳动物细胞染色体畸变试验+体外小鼠淋巴瘤TK试验。下文将详细介绍遗传毒性试验之一——体外小鼠淋巴瘤TK试验方法的试验步骤和关键要点。

检验依据
检验依据
GB/T 16886.3-2019 医疗器械生物学评价 第 3 部分:遗传毒性、致癌性和生殖毒性试验
ISO 10993-3:2014 Biological evaluation of medical devices -Part 3:Tests for genotoxicity, carcinogenicity and reproductive toxicity
YY/T 0870.3-2019 医疗器械遗传毒性试验 第3部分:用小鼠淋巴瘤细胞进行的 TK 基因突变试验

体外小鼠淋巴瘤TK试验方法步骤

复苏细胞
从液氮或冷冻柜取出TK细胞迅速解冻复苏。样品浸提:根据技术要求制备供试品浸提液。试剂制备:根据标准配置需要的试剂备用。
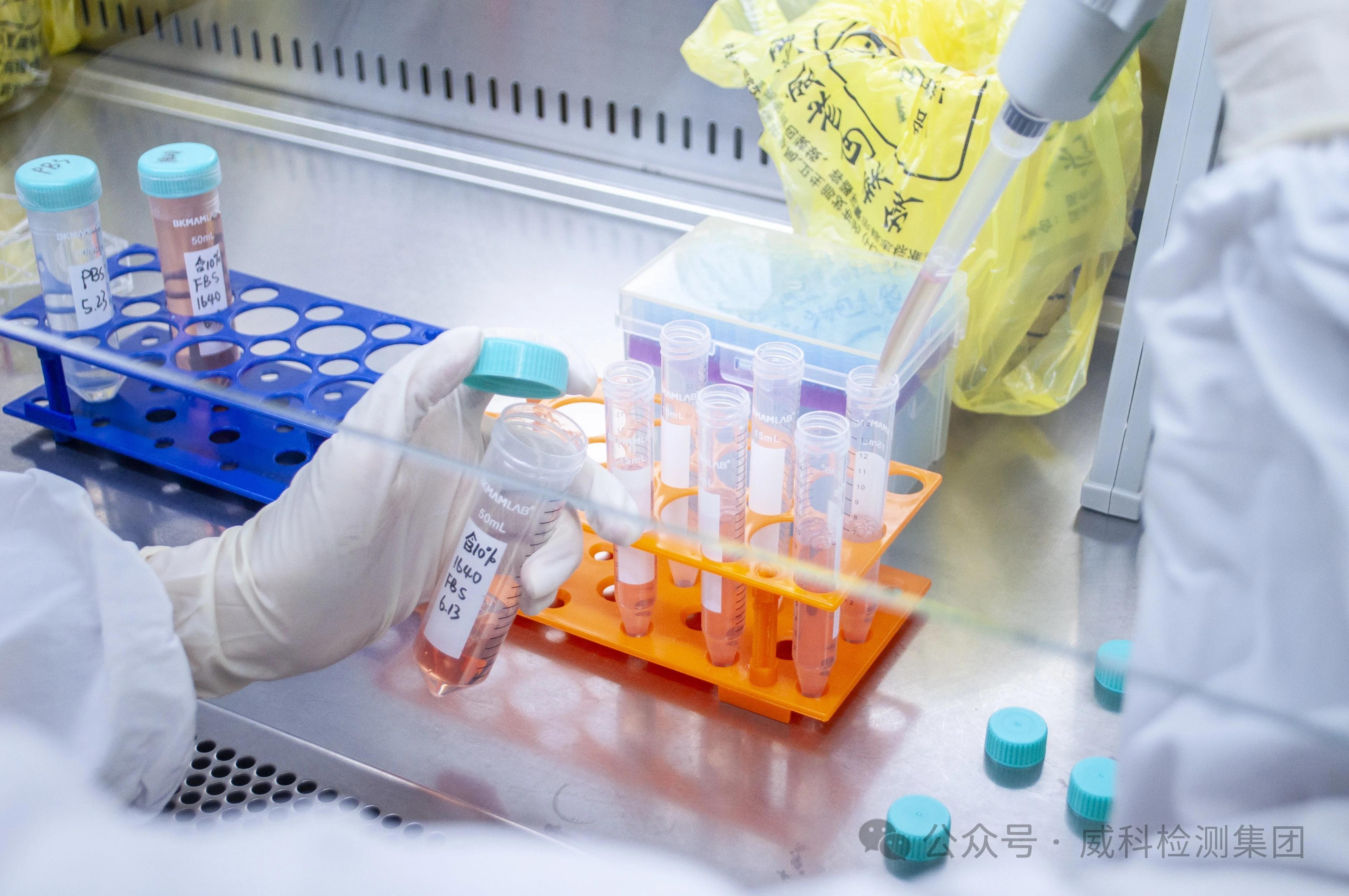

接触处理(0.9%氯化钠作为介质)
无活化组10ml细胞悬液与2ml供试品浸提液以及1mlPBS混合,加入含血清培养基至20ml;活化组取10ml细胞悬液与2ml供试品浸提液以及S9混合液1ml,加入含血清培养基至20ml。置于37°C振荡培养4h,振荡频率为75r/min。
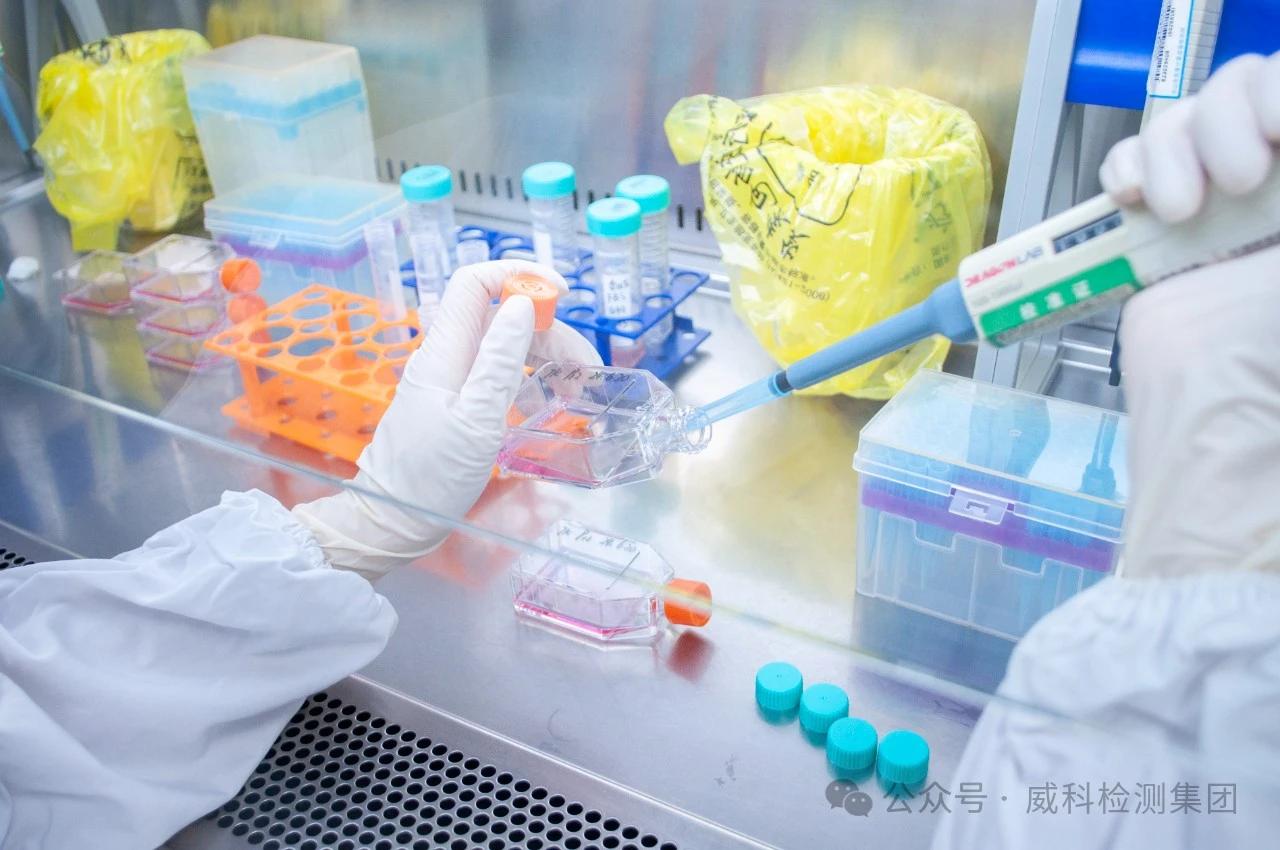

表达、第一天的平板接种效率(PE0)
短期接触组接触4h,长期接触组接触24h。
接触后离心,弃去上清液,用PBS清洗两遍,调整细胞浓度为3x105个/ml,置37°C,5%CO2培养箱培养2天。
PE0:取调整浓度为3x105个/ml的细胞悬液,用含20%血清的RPMI1640培养基梯度稀释至细胞数量为8个/ml,接种96孔板,每孔加0.2ml,接种两块平板,置37°C,5%CO2培养箱培养12天。
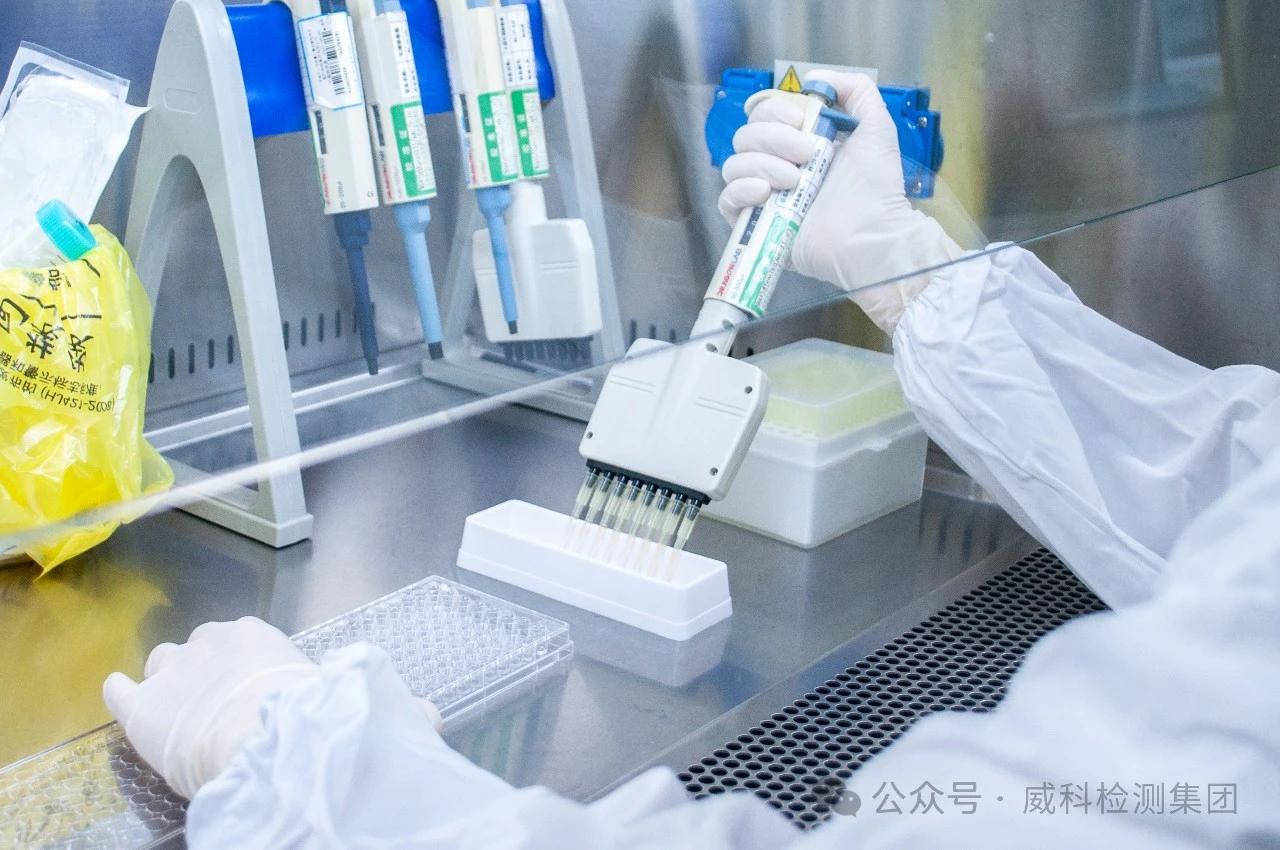
第二天的平板接种效率(PE2)、TFT拮抗平板
PE2:取表达培养结束后的细胞调整为3x105个/ml的细胞悬液,用含20%血清的RPMI1640培养基梯度稀释至细胞数量为8个/ml,接种96孔板,每孔加0.2ml,接种两块平板,置37°C,5%CO2培养箱培养12天。
TFT拮抗平板:取表达培养结束后的细胞调整为1x104个/ml,加入TFT(三氟胸苷,终浓度3μg/ml),混匀,接种96孔板,每孔加入0.2ml,接种两块平板,置37°C,5%CO2培养箱培养12天。

结果观察
目视或在显微镜及其他适宜用具下观察计数各平板无集落生长的孔数。若试验组结果为阳性,宜至少记录最高浓度阳性组以及阴性对照组和阳性对照组的大小集落数。若试验组结果为阴性,宜记录阴性对照和阳性对照的大小集落数。突变集落按大集落(LC:直径≥1/4孔径,呈薄层分布,密度低)和小集落(SC:直径<1/4孔径,呈块状,密度高)分别计数,极小集落可再继续培养3d后计数。
-
 隆重官宣丨国球荣耀再续新篇!奥运冠军马琳与威科检测集团达成品牌代言合作!2025-03-18
隆重官宣丨国球荣耀再续新篇!奥运冠军马琳与威科检测集团达成品牌代言合作!2025-03-18 -
 新闻丨中国药监研究会医疗器械专委会副主任委员卢忠一行莅临威科检测集团考察交流2025-03-18
新闻丨中国药监研究会医疗器械专委会副主任委员卢忠一行莅临威科检测集团考察交流2025-03-18 -
 中国药监研究会医疗器械专委会副主任委员卢忠一行莅临上海威科集团大型动物基地调研指导2025-03-18
中国药监研究会医疗器械专委会副主任委员卢忠一行莅临上海威科集团大型动物基地调研指导2025-03-18 -
 探秘大动物部门:DSA设备如何为医疗器械动物实验开辟新路径2025-03-17
探秘大动物部门:DSA设备如何为医疗器械动物实验开辟新路径2025-03-17 -
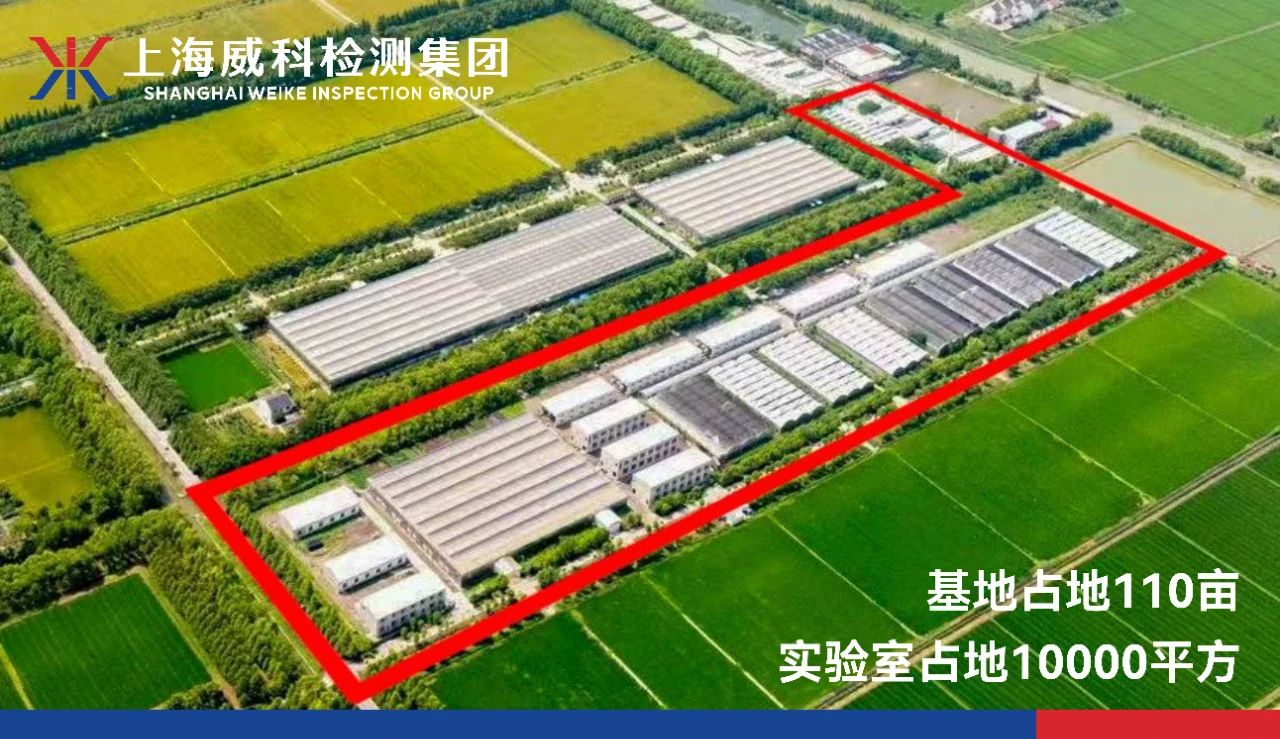 上海威科实验动物基地生物学评价板块上线,解决项目周期长痛点,助力产品快速合规上市2025-03-17
上海威科实验动物基地生物学评价板块上线,解决项目周期长痛点,助力产品快速合规上市2025-03-17 -
 团建活动 | 威科检测集团五周年庆暨“2023年度团建活动”精彩回顾2024-06-28
团建活动 | 威科检测集团五周年庆暨“2023年度团建活动”精彩回顾2024-06-28 -
 《重组胶原蛋白医用敷料体外透皮吸收评价指南(荧光标记法)》团体标准发布实施2024-01-02
《重组胶原蛋白医用敷料体外透皮吸收评价指南(荧光标记法)》团体标准发布实施2024-01-02 -
 威科检测集团苏州2023《第一届医疗器械质量与研发大会》圆满结束!2023-12-25
威科检测集团苏州2023《第一届医疗器械质量与研发大会》圆满结束!2023-12-25 -
 威科检测集团亮相深圳第88届中国国际医疗器械博览会(CMEF)展会2023-12-11
威科检测集团亮相深圳第88届中国国际医疗器械博览会(CMEF)展会2023-12-11 -
 威科检测·下川岛团建之旅|团结拼搏 共创未来2022-08-27
威科检测·下川岛团建之旅|团结拼搏 共创未来2022-08-27 -
 热烈庆祝我司顺利取得CNAS认可资质2022-06-02
热烈庆祝我司顺利取得CNAS认可资质2022-06-02 -
 广东威科实验动物使用许可证申请顺利通过省科技厅现场评2020-05-28
广东威科实验动物使用许可证申请顺利通过省科技厅现场评2020-05-28










