威科检测定制化技术服务丨助力重组胶原蛋白合规上市
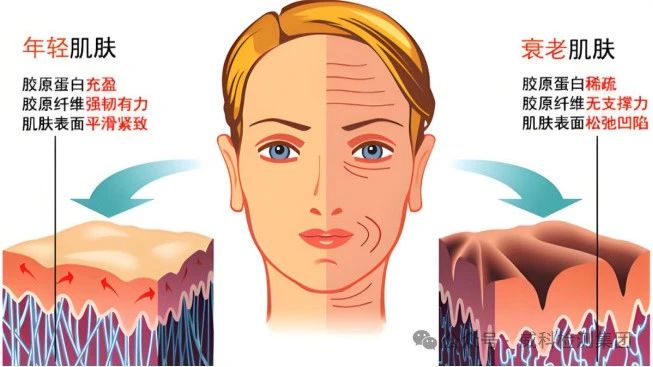
胶原蛋白广泛分布于动物体内,是人体中含量最多的一类功能性蛋白质,也是缔组织中的主要成分,约占人总蛋白的30%,在某些生物体内的含量甚至高达 80% 以上。
胶原蛋白是皮肤外基质的主要成分,可以为组织的形成和伤口的愈合承当支架的作用,有利于细胞在皮肤受损部位的黏附和迁移,促进组织和伤口的修复[1]。胶原蛋白是一类可降解的生物高分子,具有低免疫原性及促细胞增殖分化的特性,可以很好的促进皮肤创面的修复,因此胶原蛋白在医疗器械、生物支架材料、化妆品、功能性食品等多种领域被广泛的应用[2]。
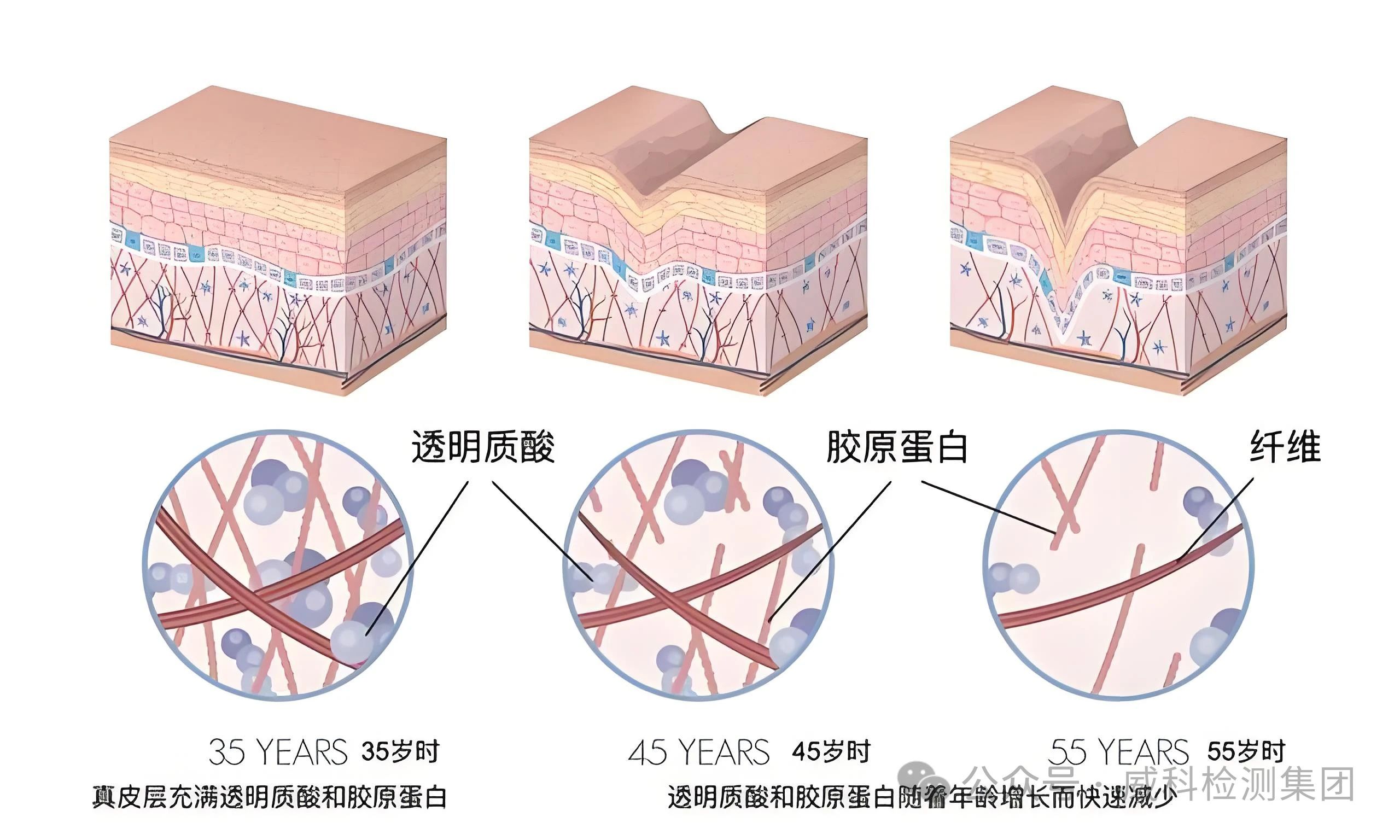
至今已发现的胶原蛋白有28种类型,主要分为纤维性胶原蛋白、网状胶原蛋白、珠状丝状胶原蛋白、锚定纤维蛋白、膜蛋白以及multiplexins胶原蛋白,其中纤维性胶原蛋白中Ⅰ型、Ⅱ型、Ⅲ型胶原蛋白占人体胶原蛋白的 80%~90%。目前,根据来源胶原蛋白大致分为动物源胶原蛋白和重组胶原蛋白。
动物源胶原蛋白主要来源于陆生动物以及海洋动物,而重组胶原蛋白是指将人胶原蛋白基因克隆到选定的表达载体并转化到表达细胞内,最后通过纯化技术所获得的蛋白质[3]。
重组胶原蛋白:以生物体内胶原蛋白的氨基酸序列为模板,对其进行合理的设计、酶切和 拼接后借助合成生物学技术转入到以大肠杆菌、毕赤酵母菌为主的工程细胞内,并利用工程细胞的快速生产能力制备获得的胶原蛋白。
重组人源胶原蛋白:如果是以人的胶原蛋白为模板,设计和拼接得到的重组胶原蛋白就被称为重组人源胶原蛋白。
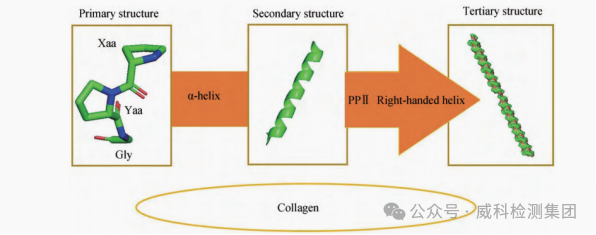
胶原蛋白结构[4]
(胶原蛋白一级结构展示了胶原蛋白主要由脯氨酸、甘氨酸以及羟脯氨酸等氨基酸构成;二级结构则展示了脯氨酸、甘氨酸以及羟脯氨酸等氨基酸通过α螺旋使胶原蛋白二级结构趋于稳定;三级结构展示了3条a链经过左手螺旋构象形成原胶原)
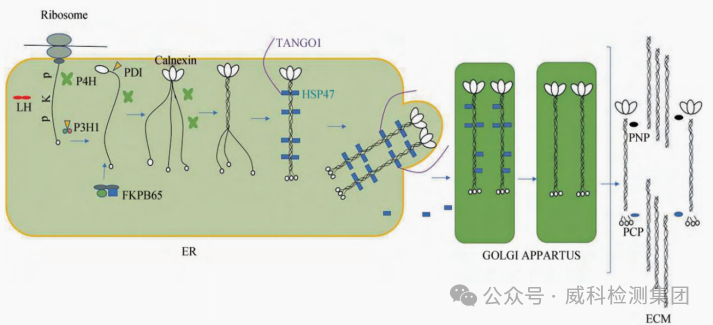
胶原蛋白合成机制[5,6]
(P一脯氨酸残基;K一赖氨酸残基;P4H一脯氨酰4-羟化酶;LH一赖氨酰羟化酶;P3H1一脯氨酰3-羟化酶;HSP47-热休克蛋白47;PDI-二硫异构酶;FKPB65一免疫亲蛋白;PNP一原胶原N端酶;PCP-原胶原C端酶)
在我国以“创新”为国家战略,大力支持发展“生物基新材料”的大背景下,胶原蛋白吸引了越来越多参与者,基于重组胶原蛋白的诸多优势,其市场正在迅速扩大。数据显示,2022年我国重组胶原蛋白市场规模为 185 亿元,占胶原蛋白市场规模的 46.6%,同比增长 71.3%;2017~2022 年的年均复合增长率为 65.3%,预计到 2027 年,我国重组胶原蛋白市场规模将达到 1083 亿元,占胶原蛋白市场规模的 62.3%[7]。
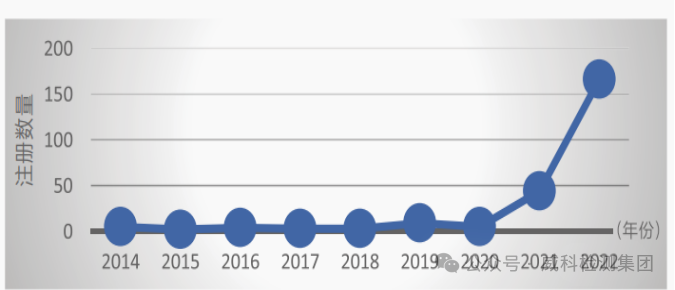
重组胶原蛋白类产品年注册数量[7]
根据国家药品监督管理局网站上查询结果,截止2023年9月,查询到含重组胶原蛋白类产品相关记录343条,全部为国产医疗器械,注册产品分布于21个省,其中以湖南省药监局审批量居多,其次为黑龙江省和江苏省。含重组胶原蛋白类产品注册自2014年始,于2021年起申报数量急剧增加,2022年注册数量最多高达166件,目前此类产品的注册申请仍在不断增长[8]。同时,胶原蛋白相关产品也在保健食品、美容护肤等领域迎来巨大的发展,预计未来市场规模将达到5000亿元。
我国胶原蛋白产品种类丰富,但与此同时,我国胶原蛋白技术研发领域仍然存在安全风险高和生物活性低等问题[9]。
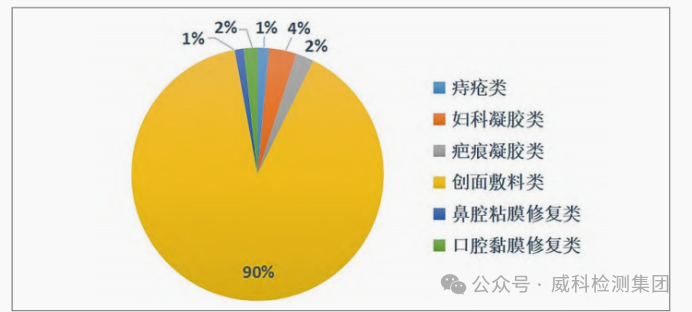
含重组胶原蛋白产品分类[7]
近年来,国家药品监督管理局先后颁布多项重组胶原蛋白行业标准及政策法规文件,对规范当前已经形成的行业业态的有序发展起到了重要作用。2021年3月,国家药品监督管理局和相关技术单位组织制定了《重组胶原蛋白类医疗产品分类界定原则》,2021年4月,国家药监局发布了《重组胶原蛋白类医疗产品分类界定原则》。为进一步规范重组胶原蛋白原材料的质量控制,2022年1月,YY/T 1849-2022《重组胶原蛋白》行业标准正式发布;2023年1月,YY/T 1888-2023《重组人源化胶原蛋白》行业标准正式发布,同年7月20日该标准正式实施,充分体现了国家对重组胶原蛋白原材料在医疗器械领域应用的认可,也对企业和研究机构研发相关原材料提供了指导。

2023年5月国家药监局发布了《重组胶原蛋白创面敷料注册审查指导原则》《重组人源化胶原蛋白原材料评价指导原则》。2023年7月21日,全国医用防护器械标准化工作组发布《重组胶原蛋白敷料》行业标准征求意见稿;2023年8月4日,医疗器械标准管理研究所对外发布《医用敷料类产品分类界定指导原则(征求意见稿)》。在国家的大力支持下,重组胶原蛋白敷料类产品配套法规和相关标准日趋完善[10]。

在遵循行业规范和技术指导原则的前提下,对于作为原材料的重组胶原蛋白,需进行全面且严格的技术评估。这包括但不限于对其理化特性的测试、成分鉴别、杂质、污染物及添加剂的严格筛查、结构特征的详细表征、生物学功能的评估以及生物学安全性的评价。对于按照二类医疗器械管理的重组胶原蛋白创面敷料,在提交申报材料时,除了需要提供关于产品性能指标的检测数据、生物学特性的深入研究和稳定性研究的详细资料外,还需特别提供关于该产品不可被人体吸收的科学研究资料。这些资料将确保产品在使用过程中的安全性和有效性,以及确保其在医疗应用中的合规性。
威科检测集团有限公司作为医疗器械及相关领域专业权威检测机构,致力于共创生物医药检测服务创新平台,具备国家CMA(中国计量认证)和CNAS(中国合格评定国家认可委员会)双重资质,同时,也是T/GDMDMA 0029-2023《重组胶原蛋白医用敷料体外透皮吸收评价指南(荧光标记法)》团体标准的制定单位。
威科检测集团有实验室面积约11000平方米,环境设施包括大动物实验中心、SPF级动物房、病理检测室、化学表征分析实验室、微生物实验室、医疗器械性能检测实验室等,拥有专业的技术人员,具有丰富的医疗器械行业的从业经验,且集团配备有渗透压摩尔浓度测定仪、红外光谱、液相色谱、液质联用、ICP-MS等高精尖的仪器设备,可为各类胶原蛋白产品提供从原料到产品的全流程检测与验证的一站式服务,如灭菌验证、产品质量检测、生物学评价、临床前动物试验及包装运输等,为产品的注册备案和上市提供有力技术支持。




参考检测指标
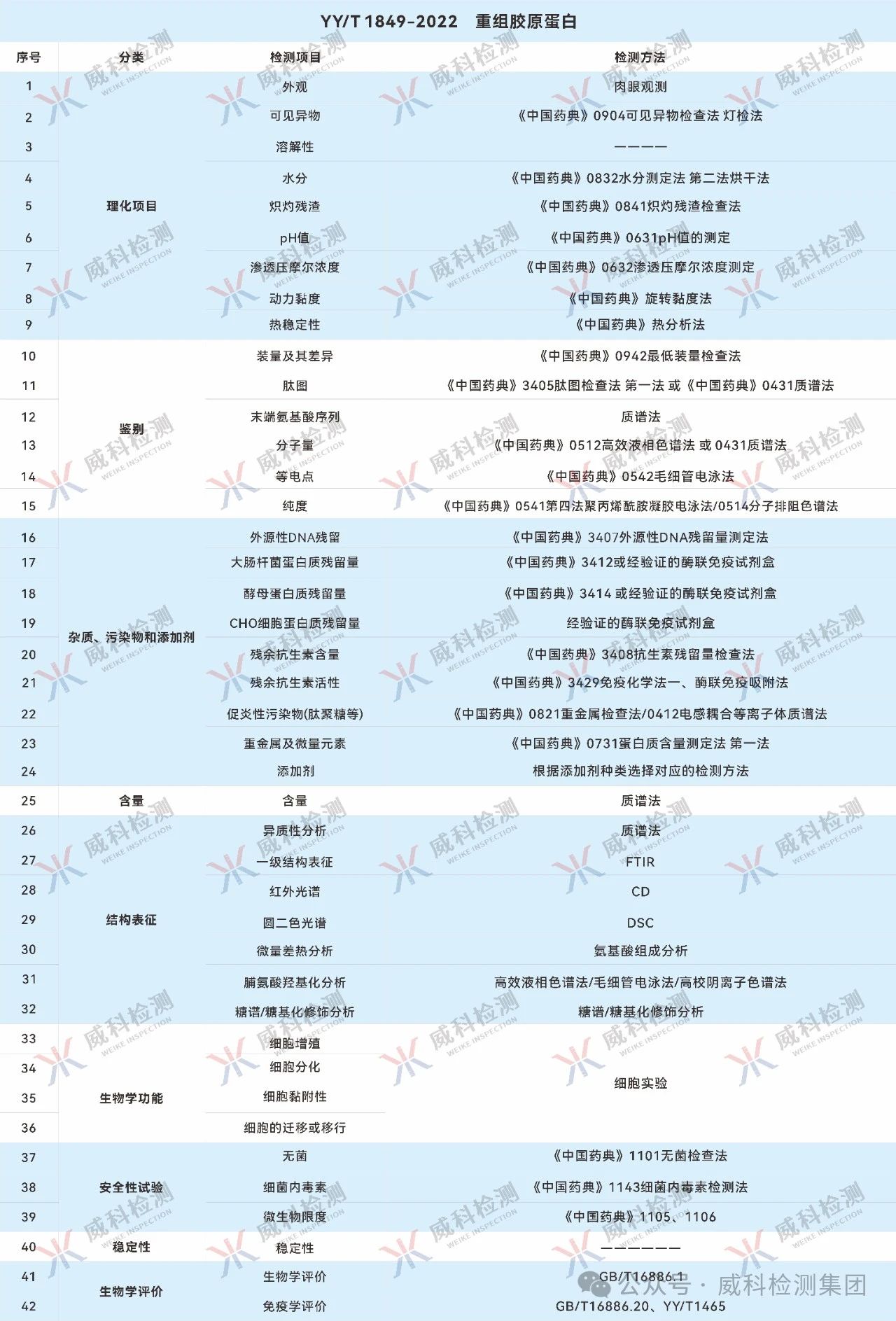
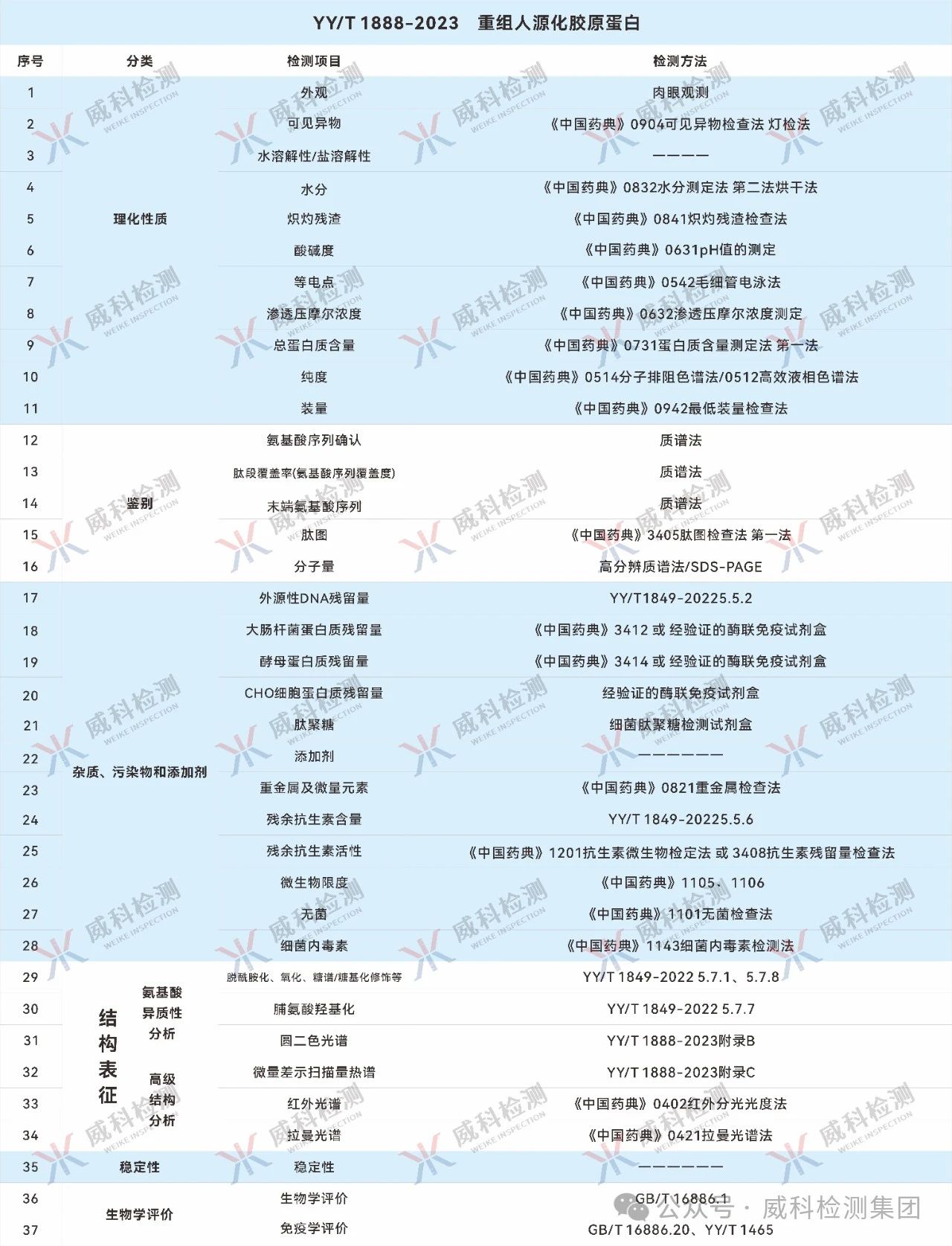
参考文献:
[1]白爽,夏志宽,敖俊红,等.胶原蛋白与皮肤创伤修复[J].实用皮肤病学杂志,2022,15(5):296.
[2]叶滔,项琪,杨艳,等.胶原蛋白的开发与应用研究进展[J].生物工程学报,2023,39(3):962.
[3]潘家豪,潘炜松,邱健,等.重组胶原蛋白表达体系研究进展[J].合成生物学,2023,4(04):808-823.
[4]BERISIO R, VITAGLIANO L, MAZZARELLA L, et al. Crys‐ tal structure of the collagen triple helix model [(Pro-Pro-Gly)10]3
Protein Science, 2002, 11(2): 262-270.
[5]JONES E Y, MILLER A. Analysis of structural design features in collagen[J]. Journal of Molecular Biology, 1991, 218(1): 209-219.
[6]FERTALA A. Three decades of research on recombinant colla‐gens: reinventing the wheel or developing new biomedical products?[J]. Bioengineering, 2020, 7(4): 155.
[7]傅苏颖.重组胶原蛋白千亿市场待发上市公司加码布局[N].中国证券报,2024-02-22(A06).DOI:10.28162/n.cnki.nczjb.2024.000754.
[8]楚姗姗,王晓晨,杜旭,等.含重组胶原蛋白二类医疗器械产品注册现状、临床评价及常见问题[J].中国医疗器械信息,2024,30(05):1-3+16.DOI:10.15971/j.cnki.cmdi.2024.05.048.
[9]李禾.我国重组胶原蛋白赛道持续升温[N].科技日报,2023-09-05(006).DOI:10.28502/n.cnki.nkjrb.2023.005119.
[10]周玮,邓乔,杨定勇,等.浅谈Ⅱ类重组胶原蛋白创面敷料产品注册监管的思考[J].生物化工,2024,10(01):155-159.
-
 隆重官宣丨国球荣耀再续新篇!奥运冠军马琳与威科检测集团达成品牌代言合作!2025-03-18
隆重官宣丨国球荣耀再续新篇!奥运冠军马琳与威科检测集团达成品牌代言合作!2025-03-18 -
 新闻丨中国药监研究会医疗器械专委会副主任委员卢忠一行莅临威科检测集团考察交流2025-03-18
新闻丨中国药监研究会医疗器械专委会副主任委员卢忠一行莅临威科检测集团考察交流2025-03-18 -
 中国药监研究会医疗器械专委会副主任委员卢忠一行莅临上海威科集团大型动物基地调研指导2025-03-18
中国药监研究会医疗器械专委会副主任委员卢忠一行莅临上海威科集团大型动物基地调研指导2025-03-18 -
 探秘大动物部门:DSA设备如何为医疗器械动物实验开辟新路径2025-03-17
探秘大动物部门:DSA设备如何为医疗器械动物实验开辟新路径2025-03-17 -
 上海威科实验动物基地生物学评价板块上线,解决项目周期长痛点,助力产品快速合规上市2025-03-17
上海威科实验动物基地生物学评价板块上线,解决项目周期长痛点,助力产品快速合规上市2025-03-17 -
 团建活动 | 威科检测集团五周年庆暨“2023年度团建活动”精彩回顾2024-06-28
团建活动 | 威科检测集团五周年庆暨“2023年度团建活动”精彩回顾2024-06-28 -
 《重组胶原蛋白医用敷料体外透皮吸收评价指南(荧光标记法)》团体标准发布实施2024-01-02
《重组胶原蛋白医用敷料体外透皮吸收评价指南(荧光标记法)》团体标准发布实施2024-01-02 -
 威科检测集团苏州2023《第一届医疗器械质量与研发大会》圆满结束!2023-12-25
威科检测集团苏州2023《第一届医疗器械质量与研发大会》圆满结束!2023-12-25 -
 威科检测集团亮相深圳第88届中国国际医疗器械博览会(CMEF)展会2023-12-11
威科检测集团亮相深圳第88届中国国际医疗器械博览会(CMEF)展会2023-12-11 -
 威科检测·下川岛团建之旅|团结拼搏 共创未来2022-08-27
威科检测·下川岛团建之旅|团结拼搏 共创未来2022-08-27 -
 热烈庆祝我司顺利取得CNAS认可资质2022-06-02
热烈庆祝我司顺利取得CNAS认可资质2022-06-02 -
 广东威科实验动物使用许可证申请顺利通过省科技厅现场评2020-05-28
广东威科实验动物使用许可证申请顺利通过省科技厅现场评2020-05-28










