适用产品
-
医疗器械
-
药品
-
化妆品
-
消毒产品
-
食品
-
电子烟
-
干细胞
检测介绍
医疗器械安全性和有效性评价
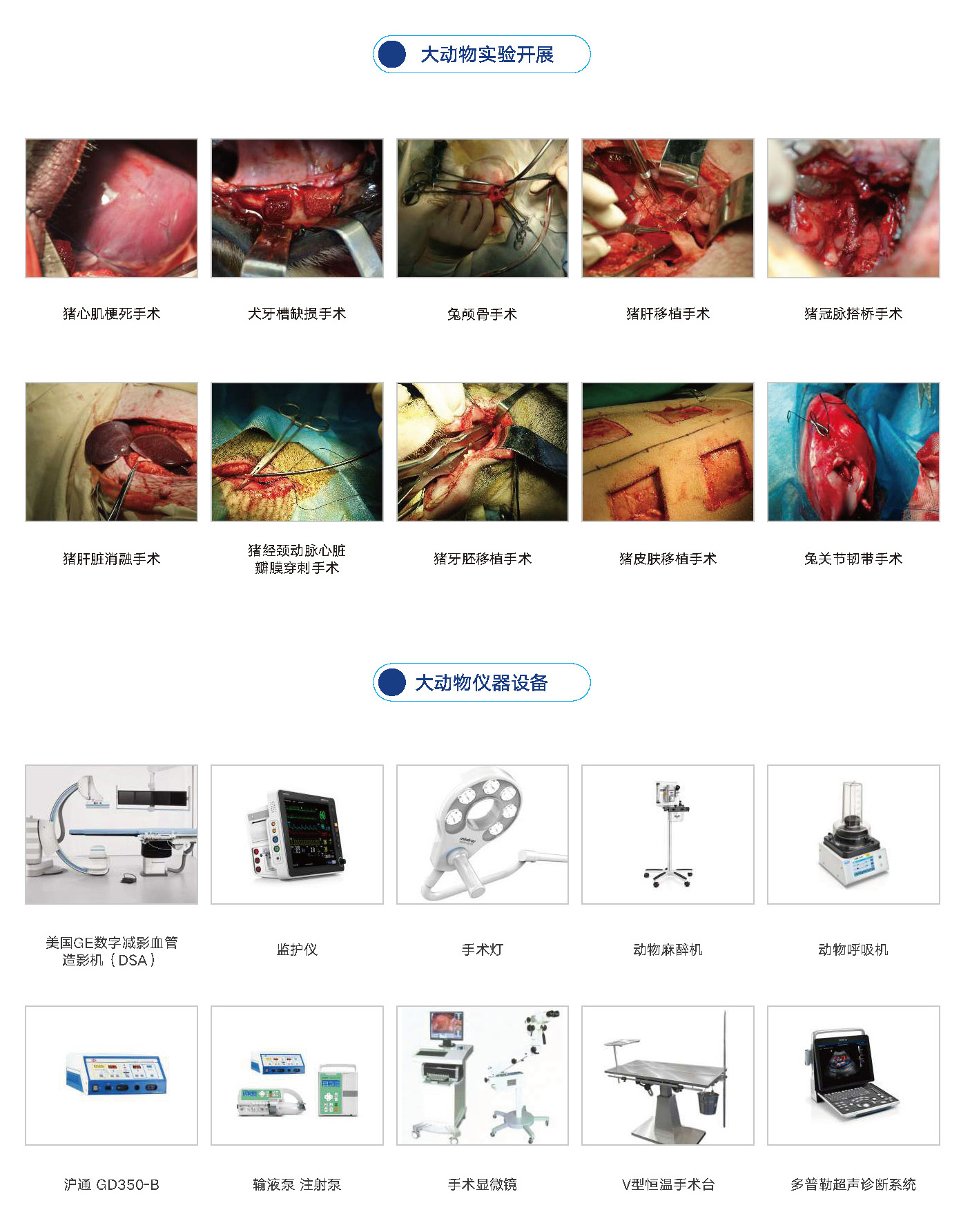
威科检测集团有限公司大动物实验区面积2300m²,猪犬最大动物饲养量各350只,猴羊最大饲养量各120只,实验团队由大型三甲医院知名临床主任医生、专业的高级动物兽医师和病理诊断专家组成。提供高端医疗器械的安全性和有效性临床前评价研究服务和大动物疾病模型研究。
检测项目:
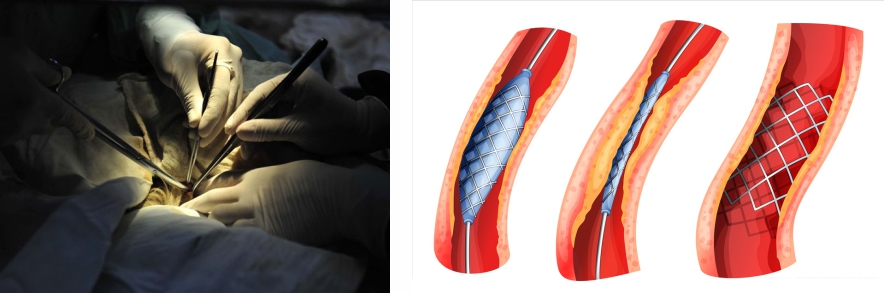
血管支架、药物洗脱支架、PTCA导管和球囊、心脏瓣膜(主动脉瓣置换)、植入式心脏起搏器、显微眼科等动物实验骨内 、金属螺钉、补片类器械、骨科/听力植入器械、人工晶状体(IOL)、生物可降解手术网、生物可降解聚合物薄膜、可降解手术缝合线、支气管等植入/介入器械、生物敷料、含壳聚糖敷料。 灌流器、血液成分分离器、体外循环产品及导管、血液透析导管及透析液,血管造影包和溶液、腹膜透析盒、止血材料、各种血袋。 生物羊膜和部分胶原类器械(胶原缝合线和补片类)、脱细胞类器械(SIS相关产品、人工角膜、神经修复材料、软骨修复材料,尿道修复材料) 。

检测标准
-
检测
- 1、
- 2、
- 3、
- 4、
- 5、
- 6、
- 7、
- 8、
- 9、
- 10、
- 11、
- 12、
- 13、
- 14、
- 15、
- 16、
- 17、
- 18、
- 19、
- 20、
- 21、
- 22、
- 23、
- 24、
- 25、
- 26、
- 27、
| 风险管理过程中的评价与试验 | GB/T 16886.1-2011 |
| 与血液相互作用试验选择 | GB/T 16886.4-2003 |
| 体外细胞毒性试验 | GB/T 16886.5-2017 |
| 植入后局部反应试验 | GB/T 16886.6-2015 |
| 刺激与迟发型超敏反应试验 | GB/T 16886.10-2017 |
| 全身毒性试验 | GB/T 16886.11-2011 |
| 样品制备与参照材料 | GB/T 16886.12-2017 |
| 风险管理过程中的评价与试验 | ISO 10993-1:2009 |
| 与血液相互作用试验选择 | ISO 10993-4:2002 |
| 体外细胞毒性试验 | ISO 10993-5:2009 |
| 植入后局部反应试验 | ISO 10993-6:2007 |
| 刺激与迟发型超敏反应试验 | ISO 10993-10:2010 |
| 全身毒性试验 | ISO 10993-11:2006 |
| 样品制备与参照材料 | ISO 10993-12:2012 |
| 生物学试验方法 | GB/T 14233.2-2005 |
| 一次性使用卫生用品卫生标准 | GB 15979-2002 |
| 医用有机硅材料生物学评价试验方法 | GB/T 16175-2008 |
| 口腔材料生物试验方法 皮下植入试验 | YY/T 0127.8-2001 |
| 《中国药典》2020版 | 四部通则 |
| 《化妆品安全技术规范》 | (2015年版) |
| 《消毒技术规范》 | (2002版) |
| 热原检查法 | YBB00022003-2015 |
| 溶血检查法 | YBB00032003-2015 |
| 急性全身毒性检查法 | YBB00042003-2015 |
| 皮肤致敏检查法 | YBB00052003-2015 |
| 皮内刺激检查法 | YBB00062003-2015 |
| 原发性皮肤刺激检查法 | YBB00072003-2015 |
其他
其他客户还浏览了这些业务